|
物质的量浓度溶液配制中的误差分析(必修1)<-->酸碱中和滴定(选修4)
中和热的测定(选修4)
(1)试剂
50ml 0.50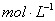 盐酸、50ml 0.55 盐酸、50ml 0.55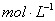 NaOH溶液 NaOH溶液
(2)仪器
大烧杯(500ml)、小烧杯(100ml)、温度计、2个量筒(50ml)、泡沫塑料或硬纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。
(3)步骤:
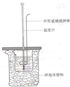
①在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃棒通过,以达到保温、隔热、减少实验过程中热量损失的目的,如图所示。
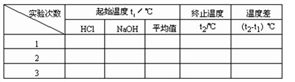
②用一个量筒量取50ml 0.50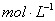 盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。然后把温度计上的酸用水冲洗干净。 盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。然后把温度计上的酸用水冲洗干净。
③用另一个量筒量取50ml0.55 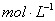 NaOH溶液,并用温度计测量NaOH溶液的温度,记入下表。 NaOH溶液,并用温度计测量NaOH溶液的温度,记入下表。
④把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合液的最高温度,记为终止温度t2 。
⑤重复实验三次,取测量所得数据的平均值作为计算依据。
(4)数据处理
中和热计算公式:
△H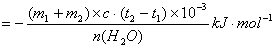
其中(m1 +m2 )表示盐酸和氢氧化钠溶液的总质量,m1 =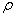 HCl ·VHCl ;m2 = HCl ·VHCl ;m2 =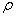 NaOH ·VNaOH NaOH ·VNaOH
C:比热容 c=4.18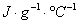
t1 :反应前盐酸和氢氧化钠溶液的平均温度
t2 :反应后溶液的最高温度
物质的量浓度溶液配制中的误差分析(必修1)<-->酸碱中和滴定(选修4)
全网搜索"中和热的测定(选修4)"相关
|

