|
盐类水解网络图<-->盐类水解的影响因素(选修4)
盐类水解的原理(选修4)
〖定义〗
在溶液中盐电离出来的离子跟水电离出来的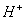 或 或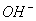 结合生成弱电解质的反应,叫做盐类的水解 结合生成弱电解质的反应,叫做盐类的水解
〖规律〗
(1)条件:有弱才水解,无弱不水解——必须含有弱酸或弱碱的离子才能发生水解,强酸强碱盐不发生水解;
(2)结果:谁强显谁性,同强显中性——盐水解后溶液的酸碱性取决于形成盐的酸和碱的相对强弱。强酸强碱盐显中性,强酸弱碱盐水解后溶液显酸性,强碱弱酸盐水解后溶液显碱性,而弱酸弱碱盐水溶液的酸碱性取决于水解生成的弱酸和弱碱的相对强弱。
(3)程度:越弱越水解,都弱都水解——盐中弱酸、弱碱的离子水解后所生成的对应弱电解质越弱,则该离子水解的程度越大,弱酸弱碱盐因阴、阳离子都能发生水解且两水解过程可相互促进,所以水解程度较大,少数可以完全水解;
|

