|
化学平衡状态的判定(必修2、选修4)<-->转化率(选修4)
化学平衡常数(选修4)
〖定义〗
一定温度下,可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值。
对于反应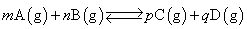 ,平衡常数表达式: ,平衡常数表达式: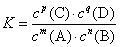
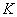 值越大,它的正向反应进行的程度越大,即该反应进行得越完全。 值越大,它的正向反应进行的程度越大,即该反应进行得越完全。
〖注意〗
在平衡常数的表达式中,不写水或固体的浓度(其浓度视为定值)
〖影响因素〗
K只与温度有关,一个确定的可逆反应,在一定温度下其平衡常数是一个定值,与反应物或生成物浓度变化无关,也与反应从正向开始还是逆向开始无关。
(1)若正反应吸热,升高温度,平衡右移,K值变大;降低温度,平衡左移,K值变小。
(2)若正反应放热,升高温度,平衡左移,K值变小;降低温度,平衡右移,K值变大。
〖意义和应用〗
(1)判断反应状态
对于反应 ,在一定温度下的任意时刻, ,在一定温度下的任意时刻, 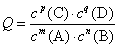
若Q<K,反应向正反应方向进行;
若Q=K,反应处于平衡状态;
若Q>K,反应向逆反应方向进行;
(2)判断反应的热效应
若升高温度,K值增大,则正反应为吸热反应;
若升高温度,K值减小,则正反应为放热反应;
化学平衡状态的判定(必修2、选修4)<-->转化率(选修4)
全网搜索"化学平衡常数(选修4)"相关
|

